lunes, agosto 07, 2006
Evaluación 2
No se olviden, please, de llenar el formularion de evaluación del curso los que aún no lo hicieron.
Suerte, denle con fé y cualquier duda escriben.
Saludos,
Víctor
viernes, agosto 04, 2006
Evaluación
Las opciones son:
1. Analizar un caso clínico.
2. Analizar un artículo.
3. Hacer un trabajo de revisión sobre la genética de algún tema o patología de su interés. Tienen hasta el lunes para proponer algo, nosotros lo "aprobamos" y ahí arrancan, sino hacen las opciones 1 o 2.
Saludos,
Víctor
martes, julio 25, 2006
Módulo 6 Casos Clínicos
Curso on-line: Introducción a
Módulo 6
Genética de las enfermedades neurodegenerativas
Historia Clínica 1:
Paciente de 46 años, con antecedentes personales de dislipemia mixta (Hipertrigliceridemia con cifras de hasta 480 mg% y HDL bajo<>
Prueba ergométrica: submáxima, negativa para nuevas áreas de isquemia, prueba presora: hiperreactividad sistólica.
Ecocardiograma: cavidades normales, leve hipoquinesia póstero-inferior, FEVI 55%, válvula aórtica calcificada con apertura conservada, sin insuficiencia.
Tratado con AAS (250 mg/d), Atenolol (25 mg/d) y Simvastatina (10 mg/d).
Es derivado para prevención secundaria. En ese momento: asintomático, examen normal, IMC: 29.3; Cintura:
Se agrega perindopril (4 mg/d) y omega 3.
A los 4 meses instala bruscamente parálisis facial central izquierda y disartria, que revierte espontáneamente a las 24 hs. TAC de cráneo: normal; Eco-doppler de vasos de cuello: placas fibrinolipídicas no obstructivas en ambos bulbos carotídeos. Espesor íntima-media normal. Disfunción endotelial severa.
Se dosifica: Proteína S, Proteína C y antitrombina III: todas normales. Homocisteinemia: 6.3umol/l, Lp(a): 16 mg%, PAI-1: 5.0 U/ml, PCR normal, Fibrinógeno: 313 mg%.
Se deriva a Policlínica de Genética Cardiovascular.
Perfil genómico:
ApoE E4/E4
ACE I/D
MTHFR C/C
ProtGB3 C/C
FV Leiden N/N
Protrombina N/N.
1. Realice la interpretación de perfil genómico en función de la historia personal y familiar.
2. ¿Qué factores de riesgo para el deterioro neurológico vinculado al envejecimiento se evidenciaron en este caso? (incluyendo genéticos y “no genéticos”).
3. ¿Cuáles son las posibles intervenciones preventivas en este caso, tanto orientadas a la enfermedad cardiovascular como a la demencia?
4. ¿Qué información sería conveniente brindar al paciente en el momento actual y en el futuro?
5. ¿Qué problemas bioéticos podría generar el manejo de la información en este tipo de casos?
6. ¿Qué sitios web le parecen de ayuda para el médico en este caso?
7. ¿Recomendaría a los pacientes visitar algún sitio web?
Historia Clínica 2:
Elaborada a partir de un caso índice con diagnóstico de Enfermedad de Parkinson (EP), de inicio a los 54 años, inicialmente buena respuesta a
Preguntas:
1. Plantee los posibles modos de herencia.
2. Plantee los posibles genes causantes de esta patología
3. Plantee como realizaría el estudio de esta familia si se tuviera acceso a laboratorios de investigación que realicen el diagnóstico molecular de mutaciones involucradas en EP de inicio precoz.
Bibliografía
· The genetic epidemiology of neurodegenerative disease. 2005. Bertram L, Tanzi RE. J Clin Invest. 115:1449-57.
· Commonalities between genetics of cardiovascular disease and neurodegenerative disorders. 2004. Helbecque N, Amouyel P. Curr Opin Lipidol. 15:121-7.
· Alzheimer’s Disease and Parkinson´s Disease. 2003. Nussbaum RL, Ellis CE. N. Engl. J. Med 348: 1356-63
sábado, julio 22, 2006
Módulo 6
Además, vean los que quieran, los materiales subidos por Andrés de otro curso sobre Genómica Médica (ese probablemente hecho con más plata).
Saludos,
Víctor
sábado, julio 15, 2006
Módulo 5
Módulo 5
Farmacogenética
Caso clínico:
Paciente de 39 años, sexo femenino, fumadora, toma anticonceptivos orales, sin otros antecedentes a destacar. Hace 2 meses episodio de trombosis venosa profunda (TVP) a nivel poplíteo de MID. Anticoagulada primero con heparina y concomitantemente con warfarina a dosis standard de 5 mg/d. Alta domicilio a los 3 días de recibir warfarina. INR al alta: 2.7. A los 7 días de comenzar la warfarina instala hematuria abundante, epístasis y equímosis difusas en zonas de traumatismos mínimos. No requirió transfusión. INR de 9.3. Se suspende warfarina y no hay otras complicaciones hemorrágicas. INR a los 3 días de suspendida la warfarina: 5. A los 5 días de suspendida: 2.7. A los 7 días: 1.34.
De la historia familiar se destaca: madre y hermana que sufrieron TVP a los 50 y 34 años respectivamente. La hermana fue tratada con warfarina, con la cual tuvo una anticoagulación dificultosa, con varios episodios de INR por encima del rango deseado y sangrados menores, pero que no requirieron suspender el tratamiento, que se prolongó por 6 meses. También tuvo eventos adversos durante el tratamiento con Fenitoína por su epilepsia.
Diagnóstico molecular: CYP2C9 *2/*3
Perfil genómico: MTHFR T/T. FV Leiden: N/M, FII: N/N.
Preguntas:
1. ¿El genotipo de la paciente es compatible con la historia referida? ¿Cuál es el efecto de estas dos variantes alélicas sobre la función proteica y sobre los fenotipos farmacocinéticos y clínicos?
2. ¿Estudiaría otros miembros de la familia con este diagnóstico genómico?
3. ¿El evento adverso con Fenitoína puede estar relacionado con el evento adverso frente al tratamiento con warfarina?
4. ¿Se pueden estudiar otros genes además de CYP2C9 para explicar este caso?
5. Comente la observación de la recurrencia familiar de TVP en este caso.
6. Interpretación de los resultados del perfil genómico. Recomendaciones de prevención y tratamiento. Recomendaciones de otros estudios.
Bibliografía:
Sanderson S, Emery J, Higgins J, CYP2C9 gene variants, drug dose, and bleeding risk in warfarin-treated patients: A HuGEnet™ systematic review and meta-analysis, Genet Med 2005:7(2):97–104.
SELIGSOHN U, LUBETSKY A,, GENETIC SUSCEPTIBILITY TO VENOUS THROMBOSIS, N Engl J Med 2001; 344(16): 1222-1231.
Artículo para analizar:
Berkovic SF, Harkin L, McMahon JM, Pelekanos JT, Zuberi SM, Wirrell EC, Gill DS, Iona X, Mulley JC, Scheffer IE, De-novo mutations of the sodium channel gene SCN1A in alleged vaccine encephalopathy: a retrospective study, Lancet Neurol. 2006; 5(6): 488-92.
BACKGROUND: Vaccination, particularly for pertussis, has been implicated as a direct cause of an encephalopathy with refractory seizures and intellectual impairment. We postulated that cases of so-called vaccine encephalopathy could have mutations in the neuronal sodium channel alpha1 subunit gene (SCN1A) because of a clinical resemblance to severe myoclonic epilepsy of infancy (SMEI) for which such mutations have been identified. METHODS: We retrospectively studied 14 patients with alleged vaccine encephalopathy in whom the first seizure occurred within 72 h of vaccination. We reviewed the relation to vaccination from source records and assessed the specific epilepsy phenotype. Mutations in SCN1A were identified by PCR amplification and denaturing high performance liquid chromatography analysis, with subsequent sequencing. Parental DNA was examined to ascertain the origin of the mutation. FINDINGS: SCN1A mutations were identified in 11 of 14 patients with alleged vaccine encephalopathy; a diagnosis of a specific epilepsy syndrome was made in all 14 cases. Five mutations predicted truncation of the protein and six were missense in conserved regions of the molecule. In all nine cases where parental DNA was available the mutations arose de novo. Clinical-molecular correlation showed mutations in eight of eight cases with phenotypes of SMEI, in three of four cases with borderline SMEI, but not in two cases with Lennox-Gastaut syndrome. INTERPRETATION: Cases of alleged vaccine encephalopathy could in fact be a genetically determined epileptic encephalopathy that arose de novo. These findings have important clinical implications for diagnosis and management of encephalopathy and, if confirmed in other cohorts, major societal implications for the general acceptance of vaccination.
Demystifying vaccination-associated encephalopathy, The Lancet Neurology, Volume 5, Issue 6, June 2006, Pages 465-466 Erick Sell and Berge A Minassian,
Background
Vaccination, particularly for pertussis, has been implicated as a direct cause of an encephalopathy with refractory seizures and intellectual impairment. We postulated that cases of so-called vaccine encephalopathy could have mutations in the neuronal sodium channel α1 subunit gene (SCN1A) because of a clinical resemblance to severe myoclonic epilepsy of infancy (SMEI) for which such mutations have been identified.
Methods
We retrospectively studied 14 patients with alleged vaccine encephalopathy in whom the first seizure occurred within 72 h of vaccination. We reviewed the relation to vaccination from source records and assessed the specific epilepsy phenotype. Mutations in SCN1A were identified by PCR amplification and denaturing high performance liquid chromatography analysis, with subsequent sequencing. Parental DNA was examined to ascertain the origin of the mutation.
Findings
SCN1A mutations were identified in 11 of 14 patients with alleged vaccine encephalopathy; a diagnosis of a specific epilepsy syndrome was made in all 14 cases. Five mutations predicted truncation of the protein and six were missense in conserved regions of the molecule. In all nine cases where parental DNA was available the mutations arose de novo. Clinical-molecular correlation showed mutations in eight of eight cases with phenotypes of SMEI, in three of four cases with borderline SMEI, but not in two cases with Lennox-Gastaut syndrome.
Interpretation
Cases of alleged vaccine encephalopathy could in fact be a genetically determined epileptic encephalopathy that arose de novo. These findings have important clinical implications for diagnosis and management of encephalopathy and, if confirmed in other cohorts, major societal implications for the general acceptance of vaccination.
Links:
PharmGKB
http://www.pharmgkb.org/
CYP2C9 Gene Variants and Clinical Outcomes of Warfarin-Treated Patients
http://www.cdc.gov/genomics/hugenet/reviews_arch.htm
sábado, julio 08, 2006
Módulo 4 Actividad 2

Curso on-line: Introducción a la Medicina Genómica
Módulo 4
1. Determinantes genéticos del daño vascular
Caso clínico 2:
Paciente de 31 años, sexo femenino, fumadora intensa, recibió ACO durante 5 años, 1 aborto espontáneo, hipertensa leve. Sufre IAM con oclusión de Descendente Anterior en tercio proximal, la cual la CACG informa como con aspecto de trombosis reciente, se le realiza Angioplastia y colocación de Stent. Cursa embarazo de 15 semanas.
Investigación de factores trombofílicos:
Prot C, S y antitrombina III: normales
Anticuerpos antifisfolipídicos: negativos.
Se desconoce homocisteinemia
Se realizó historia familiar (Figura) y se analizaron variantes en genés vinculados a su patología, determinándose el siguiente perfil genómico:
ApoE E3/E3
MTHFR 677 T/T
MTHFR 1298 A/A
PAI-1 4G/4G
ACE D/D
Prot G C825T C/C
Factor V Leiden N/N
Protrombina N/N
Preguntas:
1. Realice la interpretación de perfil genómico en función de la historia personal y familiar.
2. Haga sugerencias de estudio y tratamiento en función de la historia familiar y el perfil genómico.
3. ¿Cómo comunicaría los resultados y riesgos determinados? ¿Cómo encararía el asesoramiento genético en este caso?
Lecturas:
Aldons J. Lusis, PhD; Alan M. Fogelman, MD; Gregg C. Fonarow, MD, Genetic Basis of Atherosclerosis: Part I. New Genes and Pathways, Circulation 2004;110:1868-1873.
Aldons J. Lusis, PhD; Alan M. Fogelman MD; Gregg C. Fonarow MD, Genetic Basis of Atherosclerosis: Part II. Clinical Implications, Circulation 2004;110:2066-2071.
Sekar Kathiresan et al, Comprehensive Survey of Common Genetic Variation at the Plasminogen Activator Inhibitor-1 Locus and Relations to Circulating Plasminogen Activator Inhibitor-1 Levels, Circulation 2005;112:1728-1735.
Links:
Methylenetetrahydrofolate Reductase (MTHFR) Mutation Detection - ARUP User's Guide
http://www.aruplab.com/guides/clt/tests/clt_a85b.jsp
sábado, julio 01, 2006
Módulo 4 Actividad 1
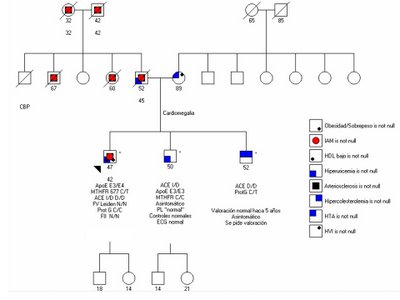
Módulo 4
1. Determinantes genéticos del daño vascular
Caso clínico 1:
Paciente de 47 años, con antecedentes personales de sobrepeso, sedentarismo, exfumador; sufre a los 42 años un IAM, se le realiza angioplastia y se coloca Stent. A los dos años nuevo episodio que requiere angioplastia en otro vaso. En la investigación de factores de riesgo cardiovascular realizada a posteriori de este episodio, se encontró: CT: 230 mg%, LDL 150 mg%, HDL 40 mg%, TG: 210 mg%.
Los números bajo el símbolo indica, de arriba a abajo, edad del individuo (o edad de fallecimiento) y edad al primer evento cardiovascular.
Se realizó historia familiar (Figura) y se analizaron variantes en genés vinculados a su patología, determinándose el siguiente perfil genómico:
ApoE E3/E4
MTHFR 677 C/T
ACE D/D
Factor V Leiden N/N
Protrombina N/N
Preguntas:
1. Realice la interpretación de perfil genómico en función de la historia personal y familiar.
2. Haga sugerencias de estudio y tratamiento en función de la historia familiar y el perfil genómico.
3. ¿Qué población consideraría en riesgo alto para patología cardiovascular? ¿Qué medidas preventivas plantearía en ellos?
4. ¿El perfil genómico implica riesgos para otros órganos blanco y territorios vasculares?
Lecturas:
Aldons J. Lusis, PhD; Alan M. Fogelman, MD; Gregg C. Fonarow, MD, Genetic Basis of
Atherosclerosis: Part I. New Genes and Pathways, Circulation 2004;110:1868-1873.
Aldons J. Lusis, PhD; Alan M. Fogelman MD; Gregg C. Fonarow MD, Genetic Basis of Atherosclerosis: Part II. Clinical Implications, Circulation 2004;110:2066-2071.
Gerdes, Lars Ulrik MD. et al: The Apolipoprotein [epsilon]4 Allele Determines Prognosis and the Effect on Prognosis of Simvastatin in Survivors of Myocardial Infarction: A Substudy of the Scandinavian Simvastatin Survival Study, Circulation 2000; 101(12):1366-1371.
Steve E Humphries, Philippa J Talmud, Emma Hawe, Manjeet Bolla, Ian N M Day, George J Miller, Apolipoprotein E4 and coronary heart disease in middle aged men who smoke: a prospective study, Lancet 2001; 358: 115–19.
Josep Redon, Felipe Javier Chaves, Youlian Liao, Jose Maria Pascual, Eduardo Rovira, Maria Eugenia Armengod, Richard S. Cooper, Influence of the I/D Polymorphism of the Angiotensin-Converting Enzyme Gene on the Outcome of Microalbuminuria in Essential Hypertension, Hypertension. 2000;35[part 2]:490-495.
Links:
HUMAN GENOME EPIDEMIOLOGY (HuGE) REVIEW, Apolipoprotein E Polymorphism and Cardiovascular Disease: A HuGE Review
